项目材料电子版发送wfyllwyh@163.com(为确保审查意见的准确性,请务必发送递交材料目录word版本,不要表格形式,递交目录请以实际的材料命名,下面表格中的只是递交材料提示)。
送审材料装订尽量简洁,材料装入孔袋,尽量有隔开标志,使用黑色两孔文件夹。档案盒及侧签要求见附件。
送审文件清单:
一、药物临床试验初始审查:
1.递交信(含所递交文件清单,注明所有递交文件的版本号或日期,格式自定,主要研究者签字)
2.临床试验受理函及回执单
3.伦理初审审查申请表
4.NMPA临床试验批件或临床试验通知书(非干预性研究、上市药提供药品说明书)
5.研究方案(注明版本号/版本日期)
6.知情同意书(注明版本号/版本日期)
7.病例报告表(注明版本号/版本日期,内容较多时建议刻盘)
8.研究者手册(注明版本号/版本日期)
9.药检报告(包括试验药、对照药)
10.申办者资质证明(生产许可证、经营许可证和营业执照复印件)及临床试验药品生产的GMP证书(CRO提供委托函),并加盖单位公章
11.组长单位伦理批件(本中心为组长单位则无需提供)
12.主要研究者资质(含简历、GCP证书复印件等)
13.多中心研究机构一览表
14.第三方样本检测说明(如有)
15.其他(患者日记、紧急联系卡、招募广告、保险声明等,如有)
备注:如有中英文版材料,请提供中文版,送审材料装订尽量简洁,使用两孔文件夹,材料装入孔袋)。
二、医疗器械临床试验初始审查:
1.递交信(含所递交文件清单,注明所有递交文件的版本号或日期,格式自定,主要研究者签字)
2.伦理初审审查申请表
3.临床试验受理函及回执单
4.产品标准
5.产品性能自测报告
6.国务院食品药品监督管理部门会同国务院质量技术监督部门认可的检测机构出具的产品注册检测报告
7.申办者资质证明(生产许可证、经营许可证和营业执照复印件)及质量认证体系或质量考核报告(CRO提供委托函)
8.研究方案(注明版本号/版本日期)
9.知情同意书(注明版本号/版本日期)
10.病例报告表(注明版本号/版本日期,内容较多时建议刻盘)
11.研究者手册(注明版本号/版本日期)
12.组长单位伦理批件(本中心为组长单位则无需提供)
13.主要研究者资质(含简历、GCP证书复印件等)
14.多中心研究机构一览表
15.第三方样本检测说明(如有)
16.其他(患者日记、紧急联系卡、招募广告、保险声明等,如有)
17.临床前研究相关资料(如有)
备注:如有中英文版材料,请提供中文版,送审材料装订尽量简洁,使用两孔文件夹,材料装入孔袋。
三、复审
1.递交信
2.复审申请表
3.修改后的方案/知情同意书等
4.修改对比说明(修改内容较多时)
5.其他相关文件
四、跟踪审查
1.修正案
(1)递交信
(2)修正案审查申请表(IEC-C-013-A01-V3.0)
(3)《研究项目修改明细表》对所有修正内容进行陈述,须有修改痕迹(删除内容使用删除线,新增内容加灰色底纹,修改痕迹必须清晰;修改原因需描述修改依据。
(4)修正后的方案/知情同意书等(注明版本号和版本日期)
(5)组长单位意见(多中心临床试验)
2.年度报告/研究进展报告
(1)递交信
(2)年度/定期跟踪审查申请报告(IEC-C-020-A01-V3.0)
(3)其他附件(另页解释或说明的文件)
(4)组长单位意见(多中心临床试验)
3.严重不良事件(SAE)报告
(1)递交信
(2)《严重不良事件报告表(SAE)》(国家药监局版本)
4.方案偏离报告
(1)递交信
(2)方案偏离报告(IEC-C-022-A01-V3.0)
(3)其他:超温药物使用需附药物稳定性报告
5.暂停/终止研究报告
(1)递交信
(2)暂停/终止研究报告(IEC-C-021-A01-V3.0)
(3)暂停/终止说明函等其他相关文件
6.结题报告
(1)递交信
(2)结题报告(IEC-C-019-A01-V3.0)
(3)本中心为组长单位,须提供总结报告,统计分析报告及分中心小结原件
(4)本中心为非组长单位,仅提供分中心小结原件或总结报告,统计分析报告
(5)其他:如无相关附件(总结报告、统计分析报告、分中心小结)请附说明,分中心小结不盖章写明原因。
五、伦理审查费
为做好伦理审查工作以及伦理档案的管理,经伦理委员会秘书核对上交资料符合要求后,通知申办者/研究者缴纳伦理审查费,并告知预定审查时间,按照递交材料先后顺序安排伦理审查会议。
伦理审查费应在伦理委员会召开会议前缴纳,以银行汇款形式交至我院财务部门,并由我院开具正式票据。伦理审查费用归医院财务部门统一管理。
收款人名称:郑州大学第五附属医院
收款账号:中国银行大学路支行 249419684836
收款地区:河南郑州
六、伦理审查的时间安排
伦理委员会常规每月开会1次,一般安排在第三周的周三下午,需要时可以临时增加审查会议,必要时可以召开紧急会议进行审查。因会前需留出一周给伦理委员会对受理材料进行形式审查以及主审委员的预审,所以,当月审查提交材料的截止日期为:每次伦理审查会议前一周周三。
七、审查决定的传达
伦理审查意见将在伦理审查会后2周之内完成。
八、伦理委员会联系方式
郑州大学第五附属医院伦理委员会,地址:郑州市二七区康复前街3号郑州大学第五附属医院17号楼405室,电话:0371-61285376,E-mail: wfyllwyh@163.com
1.初始审查申请表
2.主要研究者简历模板
3.复审申请表
4.修正案审查申请表
5.修改明细表
6.年度定期跟踪审查申请表
7.偏离方案报告
8.暂停提前终止研究报告
9.结题报告
10.档案文件夹及侧签要求

 联系我们
联系我们 地址:郑州市康复前街3号(郑州火车站西广场对面)。
地址:郑州市康复前街3号(郑州火车站西广场对面)。 乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。
乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。 地铁路线:乘坐地铁1号线至郑州火车站从C口出站。
地铁路线:乘坐地铁1号线至郑州火车站从C口出站。 急救电话:0371-6690 2126 / 6690 2120 (24小时)
急救电话:0371-6690 2126 / 6690 2120 (24小时)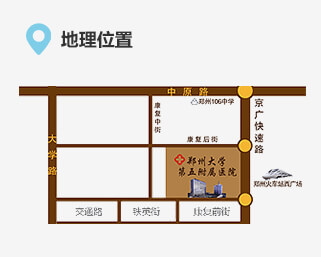 乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。地铁路线:乘坐地铁1号线至郑州火车站从C出口出站
乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。地铁路线:乘坐地铁1号线至郑州火车站从C出口出站







 李玉萍
李玉萍 杨楠
杨楠 芦秀琼
芦秀琼 田晓庚
田晓庚



 首页
首页




