临床研究登记备案指南
为掌握研究者发起的临床研究(以下简称IIT研究)现状,加强研究管理,促进临床研究规范有序发展,根据国家相关文件要求,对IIT研究在“医学研究登记备案信息系统”进行备案管理,备案流程如下:
一、适用范围:
所有由我院研究者(PI)发起的,已立项并获得伦理批件的临床研究,包括但不限于:1) 体细胞、基因治疗、异种移植相关临床试验;2)超产品说明书使用的药品或医疗器械,包括无安全数据的联合用药;3)其他应当报告的临床研究。
二、PI账号申请/忘记密码
将姓名、身份证号、邮箱、手机号四项内容提供给系统管理员,由系统管理员分配账号。
三、PI系统登录
进入 医 学 研 究 登 记 备 案 登 记 网 站 (网 址:http://114.255.48.20/login),登陆用户名为申请人手机号,初始密码为123456 ;登陆成功后,请完善个人信息。
四、项目信息填报
项目负责人根据系统提示逐步完善项目信息,具体操作可参考填报指南(网址:http://114.255.48.20/guide/index)。项目负责人应在获得伦理批件1个月内完成备案信息提交。填写过程中请注意以下内容:
1.基本信息
1) 项目名称:请与伦理批件名称保持一致;
2) 项目类型:以药物/器械/试剂盒上市为目的的临床研究选择“注册临床研究”,其它项目请选择“非注册临床研究”。
2.实施信息
是否有参与单位:如为我院发起的IIT研究请选“有”,并补充“参与单位”(分中心)信息。
3.研究内容
研究类型:根据方案设计选择“干预性研究”或“观察性研究”。研究阶段:选择最接近的选项如实填写。
4.研究设计
干预措施:如实填写,并选择“是否超说明书用药”、“是否为无安全数据的联合用药”。
5.招募信息
招募状态:选择最接近的选项如实填写。
6.其他信息
添加其他研究平台项目信息:如临床研究已在其它平台注册,请填写注册平台及注册号。
7.数据共享:
根据实际情况填写即可。
8.相关附件:
仅支持PDF格式文件。上传文件仅做机构内部审查、相关部门抽查用,不进行公示。项目信息填写完成并提交后进入伦理和机构审核流程,如有问题及时反馈PI修改。
五、咨询联系
科研与学科管理办公室(416))电话:63687953
联系人:张小娟618745、史莹。

 联系我们
联系我们 地址:郑州市康复前街3号(郑州火车站西广场对面)。
地址:郑州市康复前街3号(郑州火车站西广场对面)。 乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。
乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。 地铁路线:乘坐地铁1号线至郑州火车站从C口出站。
地铁路线:乘坐地铁1号线至郑州火车站从C口出站。 急救电话:0371-6690 2126 / 6690 2120 (24小时)
急救电话:0371-6690 2126 / 6690 2120 (24小时)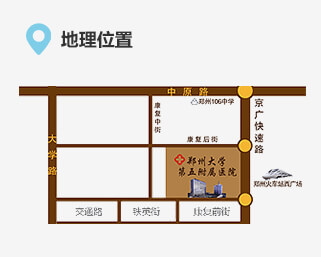 乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。地铁路线:乘坐地铁1号线至郑州火车站从C出口出站
乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。地铁路线:乘坐地铁1号线至郑州火车站从C出口出站







 李玉萍
李玉萍 杨楠
杨楠 田晓庚
田晓庚 宋俊莉
宋俊莉



 首页
首页




