
- 首页
- 医院概况
 联系我们
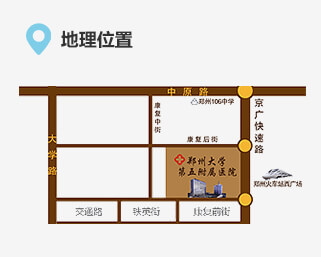
联系我们 地址:郑州市康复前街3号(郑州火车站西广场对面)。
地址:郑州市康复前街3号(郑州火车站西广场对面)。 乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。
乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。 地铁路线:乘坐地铁1号线至郑州火车站从C口出站。
地铁路线:乘坐地铁1号线至郑州火车站从C口出站。 急救电话:0371-6690 2126 / 6690 2120 (24小时)
急救电话:0371-6690 2126 / 6690 2120 (24小时)
- 科室介绍
- 就医指南
 乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。地铁路线:乘坐地铁1号线至郑州火车站从C出口出站
乘车路线:乘坐40、夜班Y17、夜班Y2、G126、G81、201、70、256、58、729、217、20、981、213、176至火车站西广场(郑州大学第五附属医院)站下车。地铁路线:乘坐地铁1号线至郑州火车站从C出口出站 - 信息公开
- 医院新闻

- 2026-01-21▪ 郑州大学第五附属医院开展“青春正能量,急救有担当”急救科普公益活动
- 2026-01-21▪ 雨雪天气暖心服务护健康——郑大五附院积极应对强降雪保障患者就医顺畅
- 2026-01-21▪ 郑州大学第五附属医院脊柱侧弯保守规范化诊治冬令营开始啦!
- 2026-01-20▪ 急救同行守平安,警民同心护生命
- 2026-01-20▪ 北京交通大学任爽教授、河南省卫生健康委员会老龄健康处毕飞先处长一行来院调研指导
- 2026-01-17▪ 暖医情·便民行丨让结算更顺畅 让就医更安心
- 科研教学
- 科学研究
- 2025-06-27▪ 郑州大学第五附属医院与河南翔宇医疗设备股份有限公司举行医企协同创新战略合作签约仪式
- 2025-04-24▪ 2025年度首席科普专家上榜!
- 2025-03-13▪ 郑州大学第五附属医院、第五临床医学院举行2025年度学科建设推进会及目标责任书签订仪式
- 2025-03-10▪ 我院荣获 “2024年度全省卫生健康科技教育工作表现突出单位”
- 2025-03-07▪ 郑州大学第五附属医院伽玛刀科受邀亮相国际学术舞台
- 2024-11-08▪ 助力科研能力提升,辅助临床诊疗——我院成功举办“数字图书馆线上专题培训活动”
- 护理风采
- 护理动态
- 2025-11-19▪ 2025年11月19日世界慢阻肺日 畅享呼吸,远离“阻”肺
- 2025-09-03▪ 匠心竞技 专业赋能︱郑州大学第五附属医院顺利举办第三届伤口造口案例大赛
- 2025-08-07▪ 打破专业壁垒,提供精准护理︱郑州大学五附院护理部顺利开展下肢动脉硬化闭塞症患者的护理多学科联合会诊(MDT)
- 2025-07-23▪ 点赞!听患者讲述郑大五附院的“免陪照护”如何破局陪护难题
- 护理科普
- 2023-01-11▪ 康复护理学——河南省医学重点学科
- 2023-01-11▪ 社区护理学——河南省医学重点学科
- 2022-12-21▪ 郑州大学五附院关于举办“第二届颅脑创伤临床护理实践与进展学习班”的通知
- 2018-09-10▪ 喜讯 | 郑州大学五附院周亚捷荣获“郑州大学护理专业教师讲课比赛”一等奖,拿到全国比赛备选资格
- 优质护理
- 2023-12-13▪ 喜讯!郑州大学五附院郭君主任护师当选河南省护理学会康复护理分会第三届委员会主任委员
- 2023-05-11▪ 郑州大学五附院韩晓霞主任护师荣获“出彩河南人”第七届最美护士
- 2023-03-27▪ 一等奖1项!二等奖1项!她们的发明在全国大赛上双丰收
- 2021-05-17▪ 郑州大学五附院心胸外科护士长李晶获得“出彩河南人”第六届最美护士称号
- 党群工作











 李玉萍
李玉萍 杨楠
杨楠 芦秀琼
芦秀琼 田晓庚
田晓庚



































































































































